Cell | 沈晓骅团队开发了一种单细胞新生转录组测序的新方法
在高等真核生物中,同一个基因组可分化出成百上千种不同的细胞类型。这种细胞多样性是由转录所驱动的,转录将基因组信息(包括编码序列和调控元件)转化为 RNA 分子,这些 RNA 分子指导蛋白质合成并塑造细胞核的组织结构。尽管编码蛋白质的 mRNA 仅占哺乳动物基因组的约 2%,但其余的非编码部分却能产生大量的非编码 RNA(ncRNA)。这些 ncRNA 通常表达水平低、不稳定、剪接不良且滞留在细胞核内,这反映了基因组的普遍活性。
新生 RNA 的分析对于揭示基因间非编码转录以及理解基因组调控至关重要。在单个细胞中,转录本质上是随机的——这一特性会影响发育过程中的细胞命运决定。然而,这种转录多样性仍知之甚少,部分原因在于技术限制。单细胞水平的转录动力学解析对于理解如何通过解读相同的基因组来产生多样化的细胞身份至关重要。
2025 年 9 月 26 日,实验室沈晓骅团队在国际顶尖学术期刊 Cell 上发表了题为:Single-cell nascent transcription reveals sparse genome usage and plasticity 的研究论文。
该研究开发了一种单细胞新生转录组测序的新方法——scFLUENT-seq,能够高灵敏、全基因组地捕获新生转录本,并更好地保留 RNA 起始信息。
要了解后生动物(多细胞动物)中从同一个基因组分化出的细胞多样性,需要进行单细胞转录分析。
在这项最新研究中,研究团队开发了一种单细胞新生 RNA 测序方法——scFLUENT-seq(single-cell full-length EU-labeled nascent RNA sequencing),采用短暂的 10 分钟代谢标记来捕获全基因组转录情况。
令人惊讶的是,从脾脏淋巴细胞到多能干细胞,单个细胞转录的基因组比例仅为约 0.02%-3.1%,而总体转录比例则超过 80%,这表明基因组的参与度有限,单个细胞与群体之间存在巨大差异,显示了新生转录的稀疏性、强随机性以及高度异质性。
该研究还发现,基因间转录,尤其是来自异染色质的转录,是普遍存在的且具有随机性的。启动子相关的反义转录和基因转录很少在同一细胞中同时发生。近端基因间转录涉及基 因读穿和独立起始,而远端基因间转录在很大程度上不受邻近基因的影响,并与转录多样性增加相关,这是细胞可塑性的标志。尽管从总体上看,全局范围内的 RNA 合成与降解是相互关联的,但在单个细胞中,单个 mRNA 的转录和降解却协调性很差,这表明存在噪声缓冲机制。
该研究的核心发现:
- 每个细胞中仅有 <3.1% 的基因组被转录,表明基因组的参与度有限;
- 单细胞转录具有随机性,尤其是在基因间异染色质区域;
- mRNA 与近端/远端非编码 RNA 表现出不同的转录动力学和调控机制;
- mRNA/ncRNA 转录多样性预示细胞可塑性——先于命运决定。
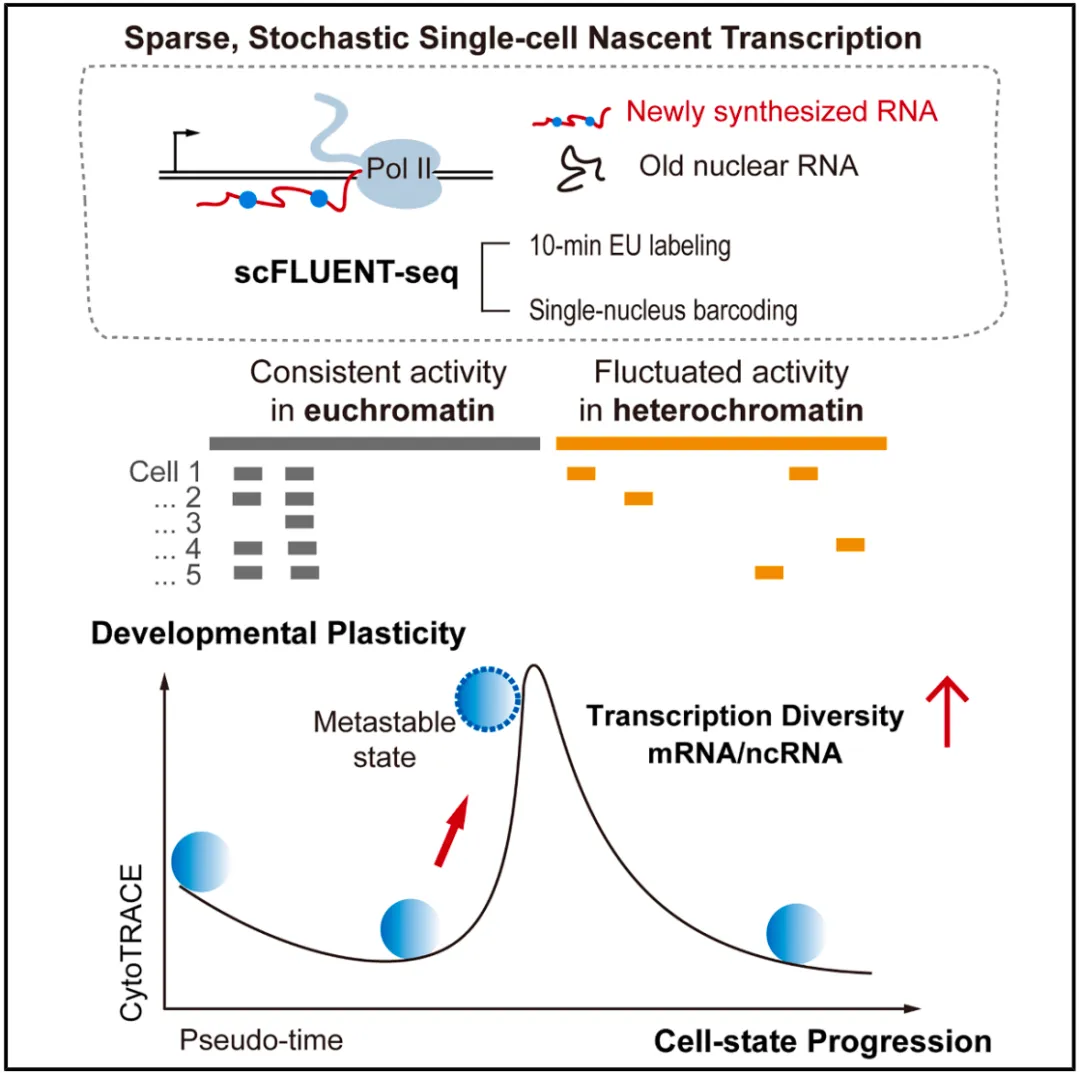
总的来说,scFLUENT-seq 揭示了复杂编码和非编码转录动态,这些动态是单细胞异质性和状态转换的基础。该研究首次系统回答了单细胞水平上基因组利用率的问题,揭示了新生转录的稀疏性、随机性和异质性,并构建了全基因组单细胞转录调控图景,为理解细胞命运的多样性提供了新的量化视角。
论文链接:
https://www.cell.com/cell/abstract/S0092-8674(25)01034-7


